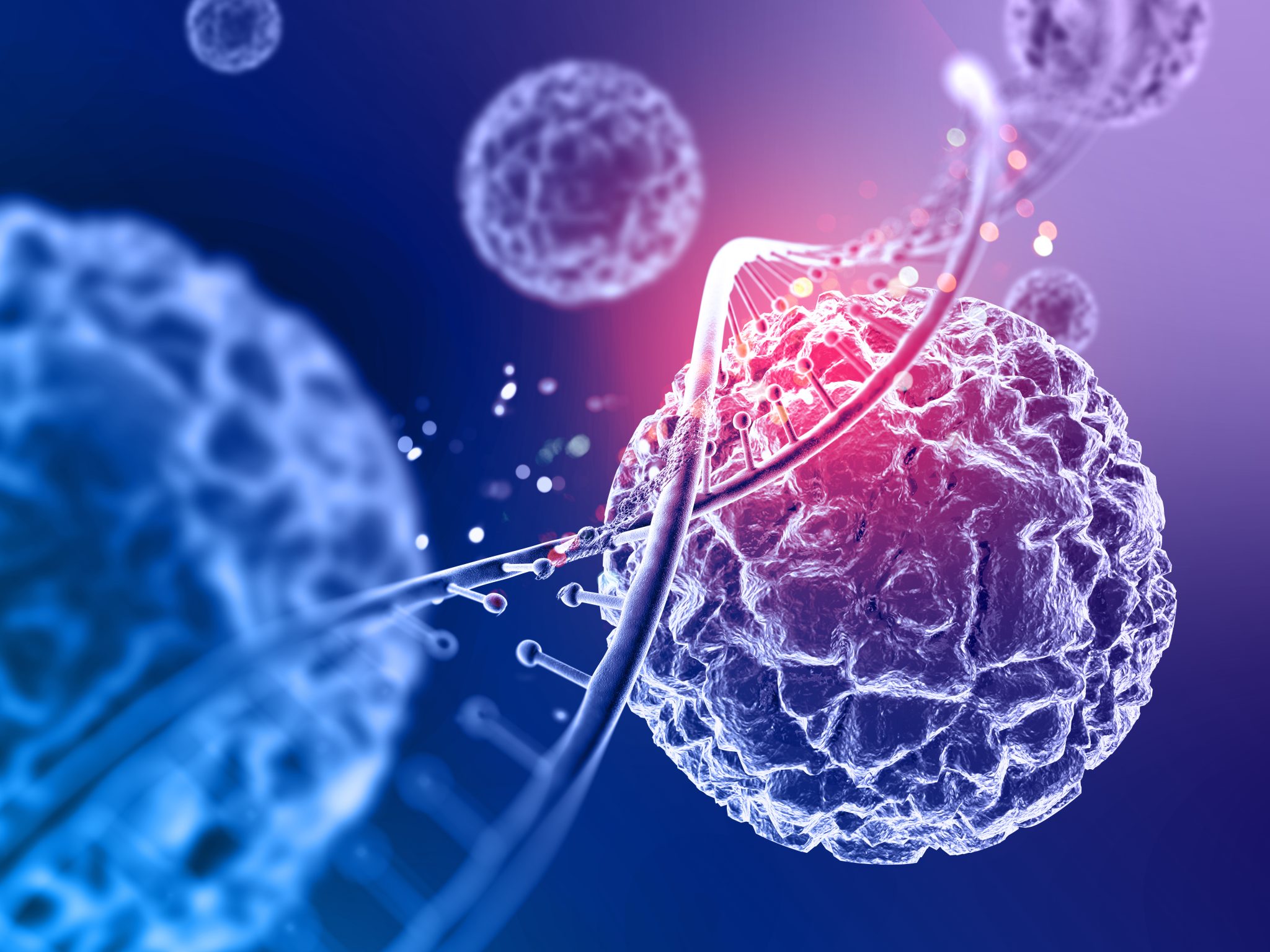
Uma equipe de pesquisadores chineses criou uma nova versão da terapia celular CAR-T que é mais eficaz no combate a tumores sólidos, um dos grandes desafios na área da oncologia atualmente. A inovação une as já conhecidas células CAR-T a um nanogel inteligente que contém uma enzima chamada hialuronidase.
As células CAR-T representam uma técnica avançada de imunoterapia, onde os linfócitos T do paciente são alterados em laboratório para identificar e atacar células cancerígenas. Essa estratégia tem mostrado grande sucesso em certos tipos de câncer hematológico, como leucemias, mas enfrenta dificuldades no tratamento de tumores sólidos, como os de mama, pulmão ou pâncreas.
O maior desafio em relação aos tumores sólidos são as barreiras físicas criadas pela matriz extracelular (MEC), uma espécie de “rede” que envolve os tumores, impedindo a efetiva entrada das células CAR-T. Mesmo com a adição da enzima hialuronidase, que tem a função de desmantelar essa estrutura, a eficácia da terapia ainda era limitada, uma vez que a enzima não se acumulava em quantidade suficiente nos tumores.
Para solucionar esse problema, os cientistas, liderados pelo professor Xuesi Chen, do Instituto de Química Aplicada de Changchun, desenvolveram um sistema inovador: encapsular a hialuronidase em nanogéis que são sensíveis ao ambiente do tumor. Esses nanogéis foram então acoplados à superfície das células CAR-T, atuando como uma “carga” que transporta a enzima diretamente para o foco da doença.
Leia mais: Déficit ecológico: Humanidade esgota recursos naturais e Terra fica sobrecarregada
O nanogel foi concebido para reagir a um tipo específico de molécula em alta concentração dentro dos tumores: as espécies reativas de oxigênio (ROS). Ao identificar esse ambiente, o gel se rompe e libera a hialuronidase exatamente onde é mais necessário — dentro do tumor e não em outras partes do corpo. Assim, a enzima desmantela a barreira da matriz extracelular, permitindo que as células CAR-T ingressem e ataquem o tumor de maneira mais efetiva.
Nos testes realizados com modelos de câncer sólido em laboratório, a terapia combinada demonstrou uma taxa de inibição tumoral de 83,2%, um resultado que os cientistas consideram significativo. “A degradação da MEC causada pela hialuronidase facilitou a infiltração das células CAR-T e reduziu o microambiente imunossupressor do tumor”, comentou Chen, que também faz parte da Academia Chinesa de Ciências.
Leia mais: Médico é condenado a 43 anos de prisão por crimes sexuais
Este estudo representa um avanço crucial no desenvolvimento de terapias celulares direcionadas a tumores sólidos, um domínio que ainda enfrenta muitos desafios. A abordagem pode ser vista como uma “arma secreta” das células CAR-T, que chegam ao tumor equipadas com recursos adicionais para contornar suas defesas.
A situação no Brasil
O tratamento com CAR-T já foi autorizado pela Agência Nacional de Vigilância Sanitária (Anvisa) para certos tipos de leucemias, linfomas e mieloma múltiplo. Aquilo que pacientes que utilizam produtos comerciais, disponibilizados por três empresas farmacêuticas, enfrentam é a necessidade de recorrer ao sistema judicial para obter a cobertura dos planos de saúde, uma quantia que pode passar de R$ 3 milhões.
Atualmente, as células são coletadas no Brasil, enviadas para fábricas nos Estados Unidos ou na Europa, onde são alteradas e congeladas antes de retornarem para aplicação, um processo que pode levar mais de 40 dias. “Essa espera é inviável para muitos pacientes em estágio avançado”, destaca o imunologista Martin Bonamino, que lidera o Programa de Imunoterapia Celular e Gênica do Instituto Nacional do Câncer (INCA).
Esta investigação contou com a colaboração de cientistas de diversas instituições chinesas, incluindo a Universidade de Jilin e o Laboratório Principal de Regeneração e Transplante de Órgãos. Os pesquisadores acreditam que esse método pode servir como base para novas terapias combinadas e para a criação de outras maneiras inteligentes de administrar medicamentos diretamente nos tumores. Este estudo foi divulgado na publicação “Nano Research”.